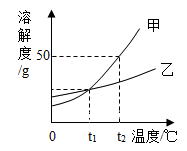
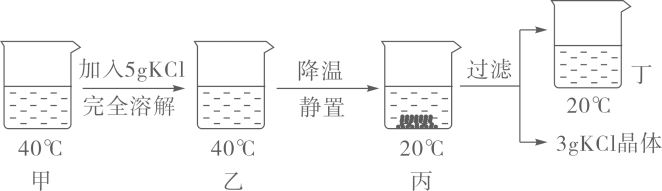
1.
将20℃时100g10%的氯化钾中溶质的质量分数增大至20%,可采取的措施是
A.
蒸发掉一半溶剂
B.
加入10g氯化钾
C.
蒸发掉50g水
D.
温度降至10℃
【考点】
溶质的质量分数及相关计算;
基础巩固
能力提升
变式训练
拓展培优
真题演练