1.
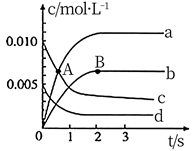
硫酸是重要的化工原料,工业制硫酸其中一步重要反应是 。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。
。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。

(1)
曲线abc中表示二氧化硫的曲线是, ,
,  的平均反应速率为,反应达到平衡时
的平均反应速率为,反应达到平衡时 的转化率为。
(2)
图中M点,正反应速率逆反应速率(填“>”“<”或“=”),若开始时更换催化效果更好的催化剂。则M点可能移动到点(填P、N或Q)。
(3)
下列说法能判断该反应达到平衡状态的是____(填标号)。
A.
的转化率为。
(2)
图中M点,正反应速率逆反应速率(填“>”“<”或“=”),若开始时更换催化效果更好的催化剂。则M点可能移动到点(填P、N或Q)。
(3)
下列说法能判断该反应达到平衡状态的是____(填标号)。
A.
 、
、 、
、 的浓度之比为
的浓度之比为 B.
生成
B.
生成 的速率与生成
的速率与生成 的速率相等。
C.
容器中压强不再改变
D.
混合气体的密度不再改变的状态
E.
混合气体的平均相对分子质量不再改变的状态
(4)
化石燃料燃烧会产生大气污染物
的速率相等。
C.
容器中压强不再改变
D.
混合气体的密度不再改变的状态
E.
混合气体的平均相对分子质量不再改变的状态
(4)
化石燃料燃烧会产生大气污染物 及氮氧化物等,用硫酸铈循环法吸收
及氮氧化物等,用硫酸铈循环法吸收 的原理如图。
(5)
如图所示装置为电化学气敏传感器,通过电压表示数可测量环境中
的原理如图。
(5)
如图所示装置为电化学气敏传感器,通过电压表示数可测量环境中 的含量。
的含量。

反应①的离子方程式,理论上每吸收标准状况下消耗
。

①溶液中向电极(填“a”或“b”)移动。
②图中所示原电池中,b极的电极反应式为。
③当b电极上消耗标况下时,该装置可测量到
为
。
【考点】
化学反应速率;
化学平衡中反应条件的控制;
化学平衡状态的判断;
化学反应速率与化学平衡的综合应用;
原电池工作原理及应用;
能力提升