1.
某同学在研究酸的性质时,发现硫酸能与金属锌反应生成氢气。锌和硫酸反应的速率与什么因素有关呢?
【建立猜想】猜想一:与硫酸的溶质质量分数有关
猜想二:与反应时的温度有关
【实验方案】
(1)
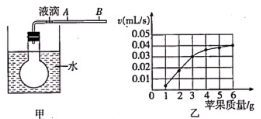
为了验证猜想一,需要选择下表中的实验①和实验数据进行分析。
(2)
结合图中实验装置,表格中“待测数据”可以是。
(3)
【实验反思】
|
|
【进行实验】……
【得出结论】硫酸的溶质质量分数越大、温度越高,锌和硫酸反应的速率越快。
某同学发现反应时锥形瓶外壁发烫,并测得某次实验生成氢气的体积随时间变化情况如图,请结合结论解释和
曲线走势不同的原因:。

【考点】
影响化学反应速率的因素;
能力提升
真题演练