1.
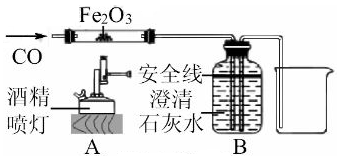
兴趣小组在实验室用如图所示装置还原氧化铁,实验过程中测得下列数据:反应前玻璃管和氧化铁粉末的总质量为66.0g(玻璃管的质量为60.0g);反应后玻璃管和管内固体粉末的总质量为65.0g(冷却到室温称量)。试回答下列问题:

(1)
实验中观察到现象后,可停止加热。
(2)
图中虚线框内的装置除了检验和吸收二氧化碳,还能起到的作用是。
(3)
小组同学查阅资料后认为反应后的固体粉末中可能混有其它铁的氧化物,请通过计算来验证他们的观点。
【考点】
还原反应与金属的冶炼;