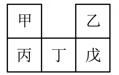
1.
图为元素周期表的一部分,请参照①~⑧在表中的位置,回答下列问题:

(1)
②在周期表中的位置是。
(2)
①~⑧中,化学性质最稳定的是(填元素符号),非金属性最强的是(填元素符号),最高价氧化物对应水化物酸性最强的是(填化学式)。
(3)
元素③的非金属性比⑥(填“强”或“弱”),请从原子结构的角度解释:,请用一个化学方程式加以说明。
【考点】
元素周期表的结构及其应用;
元素周期律和元素周期表的综合应用;
能力提升
真题演练