1.
黄铁矿[主要成分为二硫化亚铁( )]、焦炭和适量空气混合加热发生如下反应:
)]、焦炭和适量空气混合加热发生如下反应:
(1)
ⅰ.
反应ⅰ生成
 时,转移电子的物质的量为mol。
(2)
反应ⅰ所得气体经冷凝回收
时,转移电子的物质的量为mol。
(2)
反应ⅰ所得气体经冷凝回收 后,尾气中还含有
后,尾气中还含有 和
和 。将尾气通过催化剂进行处理,发生反应ⅱ,同时发生副反应ⅲ。
(3)
处理后的尾气仍含少量
。将尾气通过催化剂进行处理,发生反应ⅱ,同时发生副反应ⅲ。
(3)
处理后的尾气仍含少量 , 经
, 经 溶液洗脱处理后,所得洗脱液主要成分为
溶液洗脱处理后,所得洗脱液主要成分为 、
、 和
和 。利用生物电池技术,可将洗脱液中的
。利用生物电池技术,可将洗脱液中的 转化为单质硫(以S表示)回收。
转化为单质硫(以S表示)回收。
反应ⅰ生成
ⅱ.
ⅲ.
理论分析及实验结果表明,600~1000K范围内,平衡转化率接近100%。其他条件相同,不同温度下,
、
平衡产率和10min时
实际产率如图。

①从资源和能源利用的角度说明用反应ⅱ处理尾气的好处:。
②随温度升高,平衡产率上升,推测其原因是。
③900K,在10min后继续反应足够长时间,推测实际产率的变化趋势可能为。

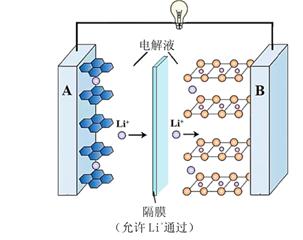
①该装置中,正极的电极反应式为。
②一段时间后,若洗脱液中的物质的量减小了
, 则理论上
减小了mol。
【考点】
电极反应和电池反应方程式;
化学平衡的影响因素;
原电池工作原理及应用;
氧化还原反应的电子转移数目计算;
能力提升