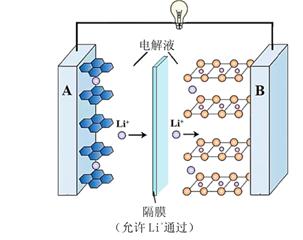
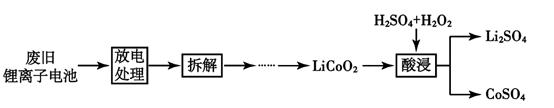
1.
2023年9月23日第19届亚运会在我国杭州正式开幕。开幕式主火炬首次使用了零碳甲醇 燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下,
燃料,充分体现了杭州亚运会“绿色、智能、节俭、文明”的办赛理念。已知一定条件下, 催化加氢生产甲醇,发生如下反应:
催化加氢生产甲醇,发生如下反应:
反应;
反应ii:。
(1)
反应体系中存在反应 , 则
, 则
 。
(2)
将
。
(2)
将 和
和 通入密闭容器中进行反应
通入密闭容器中进行反应 , 当改变某一外界条件(温度或压强)时,
, 当改变某一外界条件(温度或压强)时, 的体积分数
的体积分数 变化趋势如图甲所示:
(3)
变化趋势如图甲所示:
(3)
 轴上
轴上 点的数值比
点的数值比 点(填“大”或“小”)。
(4)
在不同压强下,按照
点(填“大”或“小”)。
(4)
在不同压强下,按照 进行投料,在容器中发生上述三个反应,平衡时,
进行投料,在容器中发生上述三个反应,平衡时, 和
和 在含碳产物
在含碳产物 和
和 中物质的量分数及
中物质的量分数及 的转化率随温度的变化如图乙所示:
(5)
光催化
的转化率随温度的变化如图乙所示:
(5)
光催化 制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原
制甲醇技术也是研究热点。如图丙铜基纳米光催化材料还原 的机理为:光照时,低能价带失去电子并产生空穴(
的机理为:光照时,低能价带失去电子并产生空穴( , 具有强氧化性)。
, 具有强氧化性)。

①平衡时,点
的体积分数为
, 则
的转化率为。(计算结果保留三位有效数字)。

①压强由大到小的顺序为。
②曲线(填“”或“
”)代表
在含碳产物中的物质的量分数。
③在 , 压强为
时,反应
的浓度平衡常数
(填含
的表达式)。
①光催化原理与电解原理类似,写出高能导带的电极反应式:。
②太阳光激发下,在导带和价带中除了产生电子和空穴外,还会生成(填写微粒名称)参与的还原再生。

【考点】
电极反应和电池反应方程式;
化学平衡常数;
化学平衡的影响因素;
化学平衡转化过程中的变化曲线;
有关反应热的计算;
能力提升