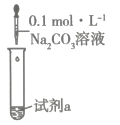
1.
碳酸钠俗称纯碱,是一种重要的化工原料,在生活、生产和实验研究中均有广泛应用。某学习小组探究 溶液与盐溶液反应的产物,进行如下实验。
溶液与盐溶液反应的产物,进行如下实验。
(1)
配制100mL 的
的 溶液。
(2)
通过下列实验探究
溶液。
(2)
通过下列实验探究 溶液与盐溶液反应,记录实验现象如下表:
溶液与盐溶液反应,记录实验现象如下表:
①配制溶液过程中用托盘天平称量固体的质量为g。
②定容时,加蒸馏水不慎超过刻度线,处理的方法是。
装置 | 实验 | 试剂a | 现象 |
| 甲 | 4mL | 产生白色沉淀 |
乙 | 4mL | 产生白色沉淀及大量气体 | |
丙 | 4mL | 产生白色沉淀及大量气体 |
为了探究白色沉淀的成分,设计了热分解实验,其装置如图所示:
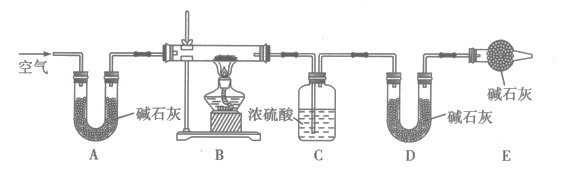
将实验乙、丙所得沉淀分别置于装置B中使样品完全分解,实验结束后,数据记录如下:
样品 | 加热前样品质量/g | 加热后样品质量/g | 装置C增重/g | 装置D增重/g |
实验乙样品 | 10.4 | 6.8 | 3.6 | 0 |
实验丙样品 | 22.4 | 16.2 | 1.8 | 4.4 |
①实验甲产生白色沉淀反应的离子方程式为。
②装置E的作用是。
③通过热分解实验可判断实验乙所得白色沉淀的成分为(填化学式),实验乙反应的离子方程式为。
④实验丙所得白色沉淀的化学式可表示为 , 则
。
【考点】
配制一定物质的量浓度的溶液;
探究碳酸钠与碳酸氢钠的性质;
离子方程式的书写;
有关混合物反应的计算;