1.
以工业副产品石膏(主要成分是CaSO4)为原料可制备CaCO3。CaCO3有球霰石、方解石等多种形态,其中球霰石广泛应用于油墨、生物材料等领域。

(1)
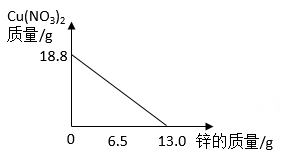
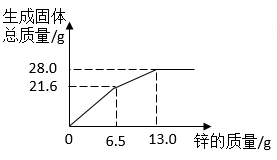
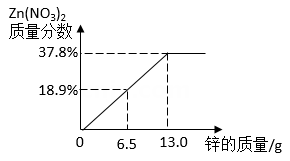
制备CaCO3时,将石膏与水配成悬浊液,再向其中通入NH3、CO2(不考虑石膏中杂质的反应)。制备过程可以看作(NH4)2CO3与CaSO4发生复分解反应,若石膏中CaSO4的质量分数为85%,取160g石膏进行反应,计算理论上可制得CaCO3的质量(写出计算过程)。
(2)
反应生成的CaCO3中球霰石与方解石的质量分数与反应时间的关系如图1所示。反应时加入某表面活性剂可增加产物中球霰石的含量,该表面活性剂一端带正电荷,另一端为排斥水分子的疏水基团,可与球霰石形成两种吸附作用,如图2所示。两种吸附分别为离子对吸附和离子交换吸附。离子对吸附:球霰石表面的CO32-带负电,表面活性剂通过带正电的一端吸附于球霰石表面;离子交换吸附:球霰石表面的Ca2+带正电,表面活性剂中带正电的一端可取代球霰石表面的Ca2+ , 并吸附于球石表面,图2中表示离子对吸附的是(填“A”或“B”)。
【考点】
根据化学反应方程式的计算;
能力提升
真题演练