1.
甲醇是重要的化工原料。利用合成气(主要成分为CO、 和
和 )在催化剂的作用下合成甲醇,发生的主要反应如下:
)在催化剂的作用下合成甲醇,发生的主要反应如下:
Ⅰ.
Ⅱ.
在恒容密闭容器进行反应Ⅰ,测得其化学平衡常数K和温度t的关系如表:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)
① 0,其理由是。
(2)
②能判断该反应达到化学平衡状态的依据是。
(3)
(4)
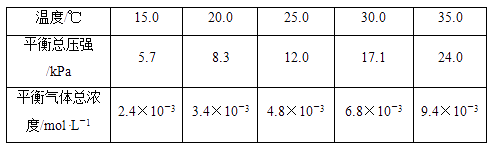
④若1200℃时,在某时刻平衡体系中
0,其理由是。
(2)
②能判断该反应达到化学平衡状态的依据是。
(3)
(4)
④若1200℃时,在某时刻平衡体系中 、
、 、
、 、
、 的浓度分别为
的浓度分别为 、
、 、
、 、
、 , 此时v(正)v(逆)(填大于、小于或等于),其理由是。
, 此时v(正)v(逆)(填大于、小于或等于),其理由是。
A. B.容器内
的体积分数保持不变
C.容器内气体密度保持不变 D.容器中压强保持不变
③图甲、图乙分别表示反应在时刻达到平衡,在
时刻因改变某个条件而发生变化的情况。图甲中
时刻发生改变的条件是,图乙中
时刻发生改变的条件是。

【考点】
化学反应速率;
化学平衡移动原理;
化学平衡状态的判断;
化学平衡转化过程中的变化曲线;
化学平衡的计算;
能力提升