1.
下表是KNO3、NaCl在不同温度下的溶解度(单位:g)
|
温度(℃) |
0 |
10 |
20 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
KNO3 |
13.3 |
20.9 |
32 |
64 |
85.5 |
110 |
138 |
169 |
202 |
246 |
|
NaCl |
35.7 |
35.8 |
36 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
(1)
60℃时,50g水中溶解32g硝酸钾形成不饱和溶液,欲使该溶液恰好达到饱和,可以恒温蒸发水的质量g(精确到1g);当其它条件不变时,也可以降温到℃恰好饱和。
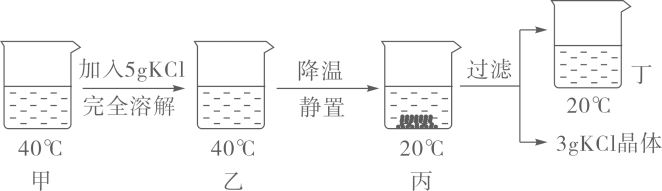
(2)
KNO3溶液中含有少量NaCl时,可通过方法提纯。析出的晶体和剩余溶液描述正确的是(填写编号)。
(3)
t℃时,将一定量KNO3的不饱和溶液平均分为三份,分别恒温蒸发出水的质量为5g、10g、15g,析出KNO3晶体的质量依次为ag、bg、cg,则a、b、c三者的关系为____。
A.
c=a+b
B.
c=2b-a
C.
c=a+2b
D.
c=2a-b
A.剩余溶液一定是当时KNO3的饱和溶液
B.剩余溶液一定是当时NaCl的不饱和溶液
C.上述方法无法将两者完全分离
D.析出的晶体中一定不含有NaCl
【考点】
固体溶解度的概念;
溶质的质量分数及相关计算;
能力提升
真题演练