1.
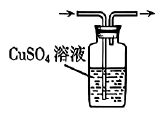
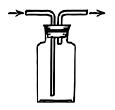
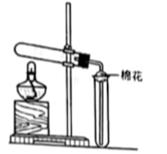
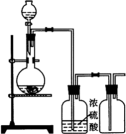
实验室中,下列气体制备的试剂和装置正确的是

选项 | A | B | C | D |
气体 | ||||
试剂 | 电石、饱和食盐水 |
|
| 稀盐酸、 |
装置 | c、f | c、e | b、e | a、d |
A.
A
B.
B
C.
C
D.
D
【考点】
气体发生装置;
气体的收集;
常见气体制备原理及装置选择;