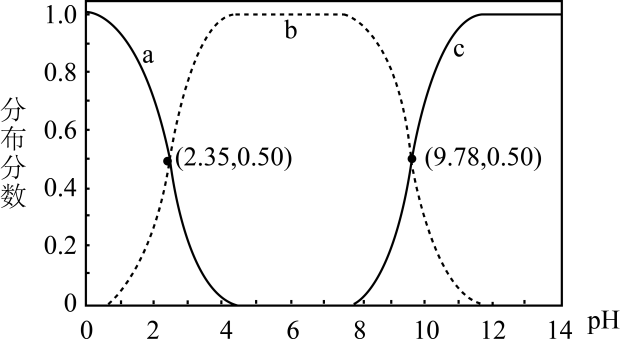
1.
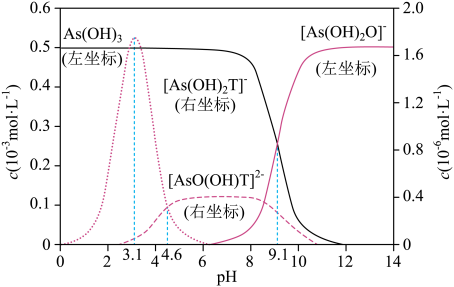
室温下,亚砷酸[As(OH)3]和酒石酸(H2T)混合体系中部分微粒的c-pH关系如图所示(浓度:总As为5.0×10-4mol•L-1 , 总T为1.0×10-3mol•L-1)。
已知:Ka1(H2T)=10-3.04 , Ka2(H2T)=10-4.37。
下列说法正确的是
A.
Ka1[As(OH)3]的数量级为10-10
B.
HT-的酸性强于[As(OH)2T]-
C.
pH=3.1时,溶液中浓度最高的微粒为[As(OH)2T]-
D.
向H2T溶液中滴加NaOH溶液至中性时:c(HT-)>c(T2-)
【考点】
离子浓度大小的比较;
电离平衡常数;
能力提升
变式训练
拓展培优
真题演练