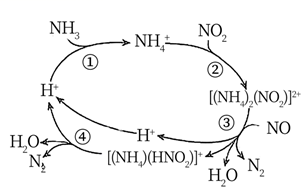
1.
实验室利用 制取高锰酸钠的相关反应的离子方程式如下:
制取高锰酸钠的相关反应的离子方程式如下:
Ⅰ:;
Ⅱ:;
Ⅲ:。
下列说法错误的是
A.
反应Ⅰ中氧化产物和还原产物的物质的量比为5∶1
B.
酸性条件下的氧化性: C.
C.
 可与盐酸发生反应:
可与盐酸发生反应: D.
制得28.4g高锰酸钠时,理论上消耗氯酸钠的物质的量为
D.
制得28.4g高锰酸钠时,理论上消耗氯酸钠的物质的量为 mol
mol
【考点】
氧化还原反应;
氧化性、还原性强弱的比较;