1.
铁及其化合物在化工、医药、材料等领域具有广泛应用,回答下列问题:
(1)
Fe元素位于元素周期表的区,与Fe同周期的所有元素的基态原子中,未成对电子数与Fe3+相同的元素有种。
(2)
FeCl3蒸汽状态下以双聚分子(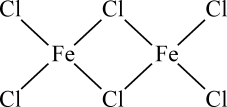 )形式存在,FeCl3的熔点(306℃)是著低于FeF3的熔点(1000℃)的原因是;FeCl3水溶液中Fe3+可水解生成双核阳离子[Fe2(H2O)8(OH)2]4+ , 结构如图所示。在该双核阳离子中,H—O—H键角(填“大于”、“小于”或“等于”)H2O的H—O—H键角;若对FeCl3水溶液进行加热,该对核阳离子内部首先断开的是键(填“a”或“b”)。
(3)
用K4[Fe(CN)6]可检验溶液中Fe3+的存在,CN-中C原子的杂化方式为,K4[Fe(CN)6]中存在(填代号)。
(4)
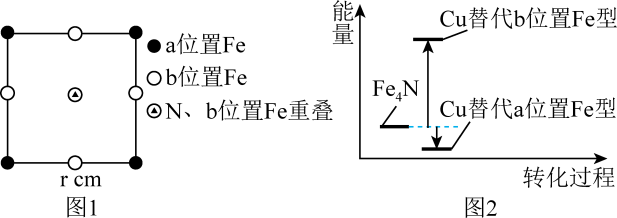
Fe4N的晶胞沿x、y、z轴投影均如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(4-n)CunN,Fe4N转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为;Fe4N晶胞中与N最近的Fe原子数为;Fe与Fe之间的最短距离为cm。
)形式存在,FeCl3的熔点(306℃)是著低于FeF3的熔点(1000℃)的原因是;FeCl3水溶液中Fe3+可水解生成双核阳离子[Fe2(H2O)8(OH)2]4+ , 结构如图所示。在该双核阳离子中,H—O—H键角(填“大于”、“小于”或“等于”)H2O的H—O—H键角;若对FeCl3水溶液进行加热,该对核阳离子内部首先断开的是键(填“a”或“b”)。
(3)
用K4[Fe(CN)6]可检验溶液中Fe3+的存在,CN-中C原子的杂化方式为,K4[Fe(CN)6]中存在(填代号)。
(4)
Fe4N的晶胞沿x、y、z轴投影均如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(4-n)CunN,Fe4N转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为;Fe4N晶胞中与N最近的Fe原子数为;Fe与Fe之间的最短距离为cm。
 )形式存在,FeCl3的熔点(306℃)是著低于FeF3的熔点(1000℃)的原因是;FeCl3水溶液中Fe3+可水解生成双核阳离子[Fe2(H2O)8(OH)2]4+ , 结构如图所示。在该双核阳离子中,H—O—H键角(填“大于”、“小于”或“等于”)H2O的H—O—H键角;若对FeCl3水溶液进行加热,该对核阳离子内部首先断开的是键(填“a”或“b”)。
)形式存在,FeCl3的熔点(306℃)是著低于FeF3的熔点(1000℃)的原因是;FeCl3水溶液中Fe3+可水解生成双核阳离子[Fe2(H2O)8(OH)2]4+ , 结构如图所示。在该双核阳离子中,H—O—H键角(填“大于”、“小于”或“等于”)H2O的H—O—H键角;若对FeCl3水溶液进行加热,该对核阳离子内部首先断开的是键(填“a”或“b”)。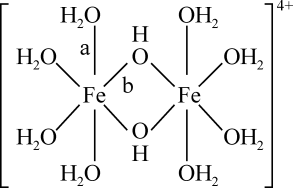
a.离子键|b.氢键 c.配位键 d.金属键
【考点】
化学键;
晶体熔沸点的比较;
晶胞的计算;
分子间作用力;
元素周期表的结构及其应用;