1.
(1)
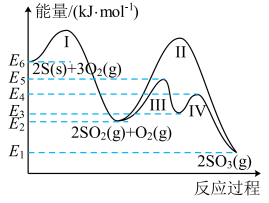
Ⅰ、大气中的二氧化碳主要来自煤、石油及其他含碳化合物的燃烧。已知 时,
时, 下,相关物质燃烧的热化学方程式知下:
(2)
已知:
下,相关物质燃烧的热化学方程式知下:
(2)
已知: , 下列说法正确的是____(填标号)。
A.
金刚石比石显稳定
B.
每放出
, 下列说法正确的是____(填标号)。
A.
金刚石比石显稳定
B.
每放出 的热量,需消耗氧气的体积为
的热量,需消耗氧气的体积为 C.
等物质的量的金刚石和石墨,完全燃烧后,石墨放出的热量更少
(3)
Ⅱ、在一定温度,
C.
等物质的量的金刚石和石墨,完全燃烧后,石墨放出的热量更少
(3)
Ⅱ、在一定温度, 下,分别在
下,分别在 密闭容器中充入
密闭容器中充入 和
和 , 发生反应:
, 发生反应: , 达平衡时,测得无毒气体的体积分数
, 达平衡时,测得无毒气体的体积分数 , 该条件下平衡常数
, 该条件下平衡常数 (
( 为以分压表示的平衡常数,分压-总压×物质的量分数)。
为以分压表示的平衡常数,分压-总压×物质的量分数)。
①;
②。
石墨在
氧气中燃烧至反应物均耗尽:
①燃烧后的产物为(填化学式),转移的电子总物质的量为。
②燃烧后放出的总热量为。
③将所得气体通入溶液中充分反应(不考虑气体的逸出),所得的盐为(填化学式),判断的依据是。
④若测得③中反应放出的总热敏为 , 已知该条件下,将
, 通入
溶液中充分反应放出
的热量。则
与
溶液反应生成
的热化学方程式为(用含m、n的式子表示)。
【考点】
吸热反应和放热反应;
热化学方程式;
能力提升