1.
我们在生活和化学实验活动中经常用到水或溶液。
(1)
硬水有害。区分硬水与软水的方法是向水样中滴加适量的,家用净水器中的活性炭(填“能”或“不能”)将硬水软化。
(2)
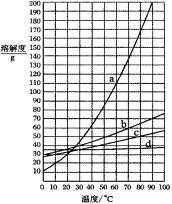
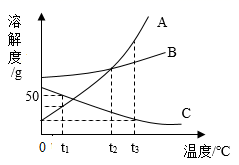
如图是A、B、C三种固体物质的溶解度曲线,据图做答:

①P点的意义是。
②A、B、C三种物质中,溶解度随着温度的上升而减小的物质是。
③t2℃时,将30gA物质加入到50g水中可形成g溶液,此时溶液是(填“饱和”或 “不饱和”)溶液。
④将t2℃时A、B、C三种物质的饱和溶液均降温至t1℃,所得溶液中溶质质量分数由大到小的顺序是。
⑤A物质中混有少量的C物质,若提纯A物质,可采用的结晶方法是。
【考点】
水的净化;
硬水与软水;
固体溶解度曲线及其作用;
能力提升
真题演练