1.
废旧铅蓄电池的铅膏中主要含有 、
、 、
、 和
和 , 还有少量
, 还有少量 、
、 、
、 的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
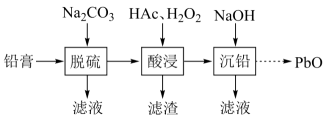
一些难溶电解质的溶度积常数如下表:
难溶电解质 | ||||
一定条件下,一些金属氢氧化物沉淀时的如下表:
金属氢氧化物 | ||||
开始沉淀的 | 2.3 | 6.8 | 3.5 | 7.2 |
完全沉淀的 | 3.2 | 8.3 | 4.6 | 9.1 |
回答下列问题:
(1)
在“脱硫”中 转化反应的离子方程式为,用沉淀溶解平衡原理解释选择
转化反应的离子方程式为,用沉淀溶解平衡原理解释选择 的原因。
(2)
在“脱硫”中,加入
的原因。
(2)
在“脱硫”中,加入 不能使铅膏中
不能使铅膏中 完全转化,原因是。
(3)
在“酸浸”中,除加入醋酸(
完全转化,原因是。
(3)
在“酸浸”中,除加入醋酸( ),还要加入
),还要加入 。
(4)
“酸浸”后溶液的
。
(4)
“酸浸”后溶液的 约为4.9,滤渣的主要成分是。
(5)
“沉铅”的滤液中,金属离子有。
约为4.9,滤渣的主要成分是。
(5)
“沉铅”的滤液中,金属离子有。
(ⅰ)能被氧化的离子是;
(ⅱ)促进了金属
在醋酸中转化为
, 其化学方程式为;
(ⅲ)也能使
转化为
,
的作用是。
【考点】
化学平衡常数;
难溶电解质的溶解平衡及沉淀转化的本质;
制备实验方案的设计;
离子方程式的书写;
能力提升


