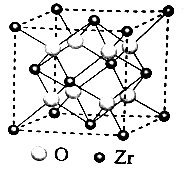
1.
回答下列问题:
(1)
有以下物质:A.HF B.Br2 C.H2O D.N2 E.C2H4 F.C2H6 G.H2 H.H2O2 I.H-C=N J. CO2 K. HCHO
(2)
C、H元素形成的化合物分子中共有16个电子,该分子中σ键与π键的个数比为
(3)
1 mol乙醛分子中含σ键的数目为,1 个
(4)
CH4、NH3、H2O、HF分子中共价键的极性由强到弱的顺序是 。
(5)
C、Si为同主族的元素,CO2和SiO2的化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不能形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成π键,而Si、O原子间不能形成上述π键? 。
①既含有极性键,又含有非极性键的是 (填序号,下同);
②既含有σ键,又含有π键的是 ;
③含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是;
④水分子是H2O而不是H3O,是因为共价键具有性;水分子的键角为104.5°,是因为共价键具有性。
CO(NH2)2分子中含有σ键的个数为。
【考点】
共价键的形成及共价键的主要类型;
真题演练
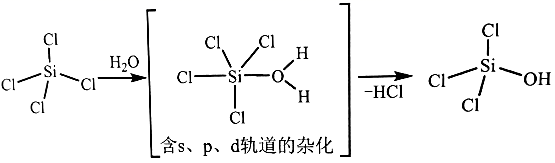 含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2 , 中间体SiCl4(H2O)中Si采取的杂化类型为(填标号)。
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2 , 中间体SiCl4(H2O)中Si采取的杂化类型为(填标号)。