1.
镍(Ni)元素存在于我们生活用品中,例如保温杯的不锈钢就含有。为了了解镍金属活动性的强弱,某兴趣小组的同学将等量的镍和镁与等质量等浓度的稀硫酸进行实验。将金属与稀硫酸同时加入反应装置中,当稀硫酸过量时记录反应时间和生成氢气质量,得到如图甲所示的图像;当金属过量时记录反应时间和生成氢气的质量,得到如图乙所示的图像。若将镁置于反应装置中,然后向反应装置中逐渐滴加稀硫酸,每加一滴完全反应后再加下一滴,以此形式滴加至过量,记录镁完全反应时生成氢气的质量和消耗稀硫酸的质量,得到如图所示的图像。(反应的化学方程式:Mg+H2SO4=MgSO4+H2↑;Ni+H2SO4=NiSO4+H2↑)
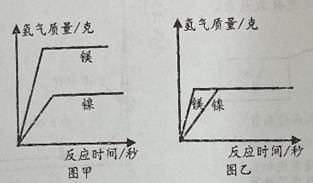

(1)
查阅资料得知,与等质量等浓度的同种酸反应,当同种金属的相同质量时,粉末状的要比块状 的反应快。则以上实验中,镁和镍还需要控制相同。
(2)
下列对于甲乙两图理解的说法正确的是 (可多选)。
A.
甲图中反应结束后两种金属一定没有剩余
B.
乙图中反应结束后稀硫酸可能有剩余
C.
甲图中反应结束后消耗稀硫酸的质量不相等
D.
乙图中反应结束后消耗稀硫酸的质量相等
(3)
取与镁等质量的镍置于反应装置中,然后采用与镁相同的方式向反应装置中滴加稀硫酸。请在丙图上画出镍与稀硫酸反应产生氢气质量与稀硫酸质量的关系图,标出镍完全反应时生成氢气质量和消耗稀硫酸的质量。
【考点】
根据化学反应方程式的计算;
金属的化学性质;
酸的化学性质;
能力提升
