1.
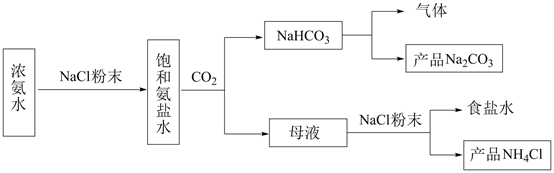
某课外活动小组模拟工业制备纯碱,方案如下:
(1)
(一)实验原理:向饱和食盐水中通入足量氨气和过量二氧化碳,析出溶解度较小的碳酸氢钠.写出相关离子方程式.
(2)
(3)
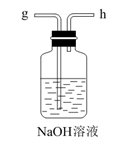
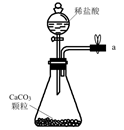
中间的烧瓶中加入20mL饱和食盐水,并将其浸入冰水中;D中加入足量氢氧化钠固体,E中加入足量浓氨水;B中加入足量碳酸钙粉末,A中加入足量稀硫酸于(可分多次加入).仪器A的名称是,选择用稀硫酸而不用稀盐酸的好处是.
(4)
先打开(填K1或K2),将装置A或E中的试剂慢慢加入圆底烧瓶.大约20分钟左右时,观察到饱和食盐水上方有现象时,再打开(填K1或K2),将装置A或E中的试剂慢慢加入圆底烧瓶,大约5分钟即有浑浊出现,约15分钟出现大量白色固体.
(5)
(四)纯碱制备:
(二)实验装置:所需实验药品和装置如图所示:

(三)实验步骤:
组装好装置,然后应该进行的操作是.
上述实验结束后,欲得到纯碱,将固体过滤、洗涤后,还需进行的操作是 (不加任何其它试剂,装置任选),反应的化学方程式为 ;若将上述操作产生的气体全部通过浓硫酸,再通过足量的过氧化钠,过氧化钠增重0.28g,则制得的纯碱质量为 g.
【考点】
纯碱工业(侯氏制碱法);
能力提升
真题演练








 已知:25℃时,
已知:25℃时, 
 B.
B. 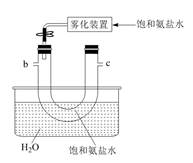 C.
C.  D.
D. 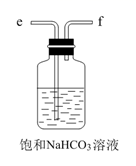 E.
E.