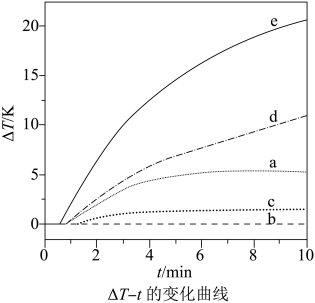
1.
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示。请回答下列问题:

(1)
A 点表示Ag2SO4是( 填“过饱和”“饱和”或“不饱和”)溶液。
(2)
该温度下Ag2SO4的溶度积常数 Ksp=。(列式代入数据并计算出结果)
(3)
现将足量的Ag2SO4 固体分别加入:
(4)
向Ag2SO4悬浊液中加入足量Na2CrO4固体,可观察到有砖红色沉淀生成(Ag2CrO4为砖红色),写出沉淀转化的离子方程式:。
a.40mL0.01mol·L-1K2SO4溶液
b.10 mL 蒸馏水
c.10mL0.02mol·L-1H2SO4溶液。
则Ag2SO4的溶解程度由大到小的顺序为(填字母)。
【考点】
难溶电解质的溶解平衡及沉淀转化的本质;
能力提升
真题演练