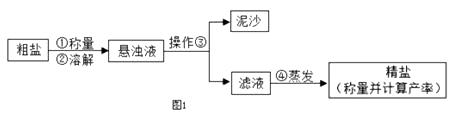
1.
碘酸钾(KIO3)主要用作食盐加碘剂
Ⅰ、制备碘酸钾
实验室制备碘酸钾的路线如下:
干海带→I2 HIO3
KIO3
(1)
KIO3中I的化合价为,含碘盐中的碘是指(填字母).
(2)
实验中需要用试纸测定溶液的pH,其操作方法是.
(3)
过滤操作需要的玻璃仪器有玻璃棒、烧杯和.
(4)
用冰水洗涤过滤所得KIO3晶体,其原因是.
(5)
温度过高,会造成H2O2利用率降低,可能的原因是.
(6)
Ⅱ测定碘含量
(7)
步骤2实验的目的是,步骤2中测试液的滴数保持一致的原因是.
(8)
若步骤3所得溶液颜色与3号试管一致,则100mL该食盐溶液中含有碘酸钾mg.该食盐中碘含量为mg/Kg,扬州地区要求(填“符合”或“不符合”).
a、离子 b、元素 c、分子
资料:
①碘酸钾与碘化钾反应方程式为:KIO3+5KI+3H2SO4═3K2SO4+3H2O+3I2
②淀粉溶液遇碘显色时,碘浓度越大颜色越深;
③扬州作为轻度缺碘地区,食盐中碘含量(以I计)应为18~33mg/Kg
步骤1:配置以下各种试剂:100g/L食盐溶液,2.14×10﹣3g/L KIO3溶液,测试液(含10g/L淀粉、196g/L H2SO4、1.66g/L KI).
步骤2:取5支相同规格小试管,贴上编号标签,按下表要求分别依次加入步骤1中配置的KIO3溶液,测试液、蒸馏水,塞上橡皮塞,混合后有序放置在试管架上(各试管中KIO3完全反应).
试管编号 | 1 | 2 | 3 | 4 | 5 |
KIO3溶液滴数 | 30 | 25 | 20 | 15 | 10 |
测试液滴数 | 10 | 10 | 10 | 10 | 10 |
蒸馏水滴数 | 0 | 5 | 10 | 15 | 20 |
步骤3:另取一支小试管,一次加入步骤1中所配置的食盐溶液10滴、测试液10滴、和蒸馏水20滴,混合后与步骤2中各试管内颜色对照.
步骤3所得溶液呈色,则说明该食盐是含碘盐.
【考点】
过滤的原理、方法及其应用;
有关元素化合价的计算;
实验探究物质的组成成分以及含量;
化学式的相关计算;
物质的相互转化和制备;