1.
根据题目要求填空:
(1)
硫、氮的氧化物是主要的大气污染物,对大气的影响之一是导致酸雨.用化学方程式表示NO2形成酸雨的原因:,该反应中氧化剂和还原剂的物质的量之比为.
(2)
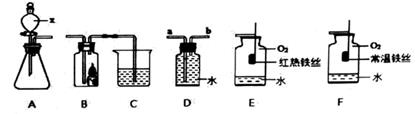
实验室常用的几种气体发生装置如图1A、B、C所示:
(3)
氢化钠(NaH)是一种还原性极强的物质,广泛应用于工业生产.
(4)
用SiHCl3与过量H2反应制备纯硅的装置如图3所示(热源及夹持装置均已略去):

实验室可以用B或C装置制取氨气,如果用B装置,反应的化学方程式是;如果用C装置,通常使用的药品是(写名称);图2是某学生设计收集氨气的几种装置,其中可行的是.若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的
A.CO2 B.NO C.Cl2 D.H2
写出A装置中反应的离子方程式.
氢化钠(NaH)中Na元素的化合价为+1,在高温下氢化钠(NaH)可将四氯化钛(TiCl4)还原成金属钛,该反应的化学方程式为.
NaH能与水剧烈反应:NaH+H2O═NaOH+H2↑,NaH与液氨(NH3)也有类似反应,该反应的化学方程式为.如果有12g NaH参加此反应,则转移电子的物质的量为mol
SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:;H2还原SiHCl3过程中若混入O2 , 可能引起的后果是.
【考点】
常见气体制备原理及装置选择;