1.
SOCl2是一种液态化合物,沸点为77℃.向盛有10mL水的锥形瓶中,小心滴加8~10滴SOCl2 , 可观察到剧烈反应,液面上有雾形成,并带有刺激性气味气体逸出,该气体中含有可使品红溶液褪色的气体.轻轻振荡锥形瓶,待白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色沉淀析出.
(1)
根据上述实验现象,写出SOCl2与水反应的化学方程式:.
(2)
蒸干AlCl3溶液不能得到无水AlCl3 , 写出有关反应的化学方程式:;;
(3)
已知常温下KSP[Al(OH)3]=1.3×10﹣33 , 若起始c(AlCl3)=1.0mol•L﹣1;则Al3+开始沉淀时的c(H+)≈ mol•L﹣1 .
(4)
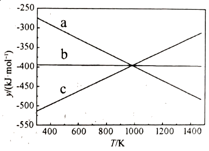
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H1=akJ•mol﹣1;
而使SOCl2与AlCl3•6H2O混合加热,可以得到无水AlCl3 , 试解释原因:.
3AlCl(g)═2Al(l)+AlCl3(g)△H2=bkJ•mol﹣1;
则反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=kJ•mol﹣1(用含a、b的代数式表示).
【考点】
热化学方程式;
真题演练