1.
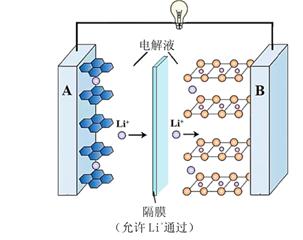
锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及炭黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:
2NH4++2e﹣=2NH3↑+H2↑.电池总反应为:2MnO2(s)+Zn(s)+NH4+(aq)=2MnO(OH)(s)+[Zn(NH3)2]2+(aq).
请回答下列问题:
(1)
电池的负极反应式为
(2)
对干电池不能进行加热或充电,否则会
(3)
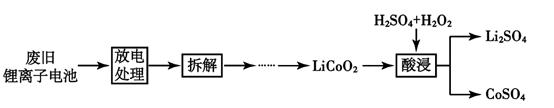
废电池糊状填充物经溶解、过滤,得到无色滤液和黑色滤渣.某课外活动小组对该滤液和滤渣进行了探究.已知:滤液的成分是氯化锌和氯化铵;Zn(OH)2是两性氢氧化物.
(4)
(5)
I.取少量滤液于试管中,滴入适量NaOH溶液产生白色沉淀至沉淀刚开始溶解,并字不要微热,生成无色刺激性气体,检验该气体的方法是 .继续往试管中滴入FeCl3溶液,白色沉淀部分转化为红褐色沉淀,则可判断Zn(OH)2的Ksp Fe(OH)3的Ksp(填“大于”、“小于”、“不能判断”),写出该反应的离子方程式
II.从黑色滤渣分离出二氧化锰,探究其在用H2O2制备O2过程中的作用.实验装置如图所示,将等量的H2O2溶液加入烧瓶中,分别进行2次实验(气体体积在相同条件下测定).
序号 | 烧瓶中的物质 | 气体体积 | MnO2的作用 |
实验1 | 足量MnO2 | 56mL | |
实验2 | 足量MnO2和稀硫酸 | 112mL |
为了准确读取量气管读数,读数时视线应与左管凹液面最低处相平,还应注意 ,实验1中MnO2的作用是催化剂,则实验2中反应的离子方程式为
用废电池的锌皮制作七水合硫酸锌(含少量金属铁),其流程如下:

试剂A是 (填化学式),操作①包括 、冷却结晶、过滤、洗涤等操作,其过程中所需的仪器有酒精灯、玻璃棒、漏斗和下列仪器中的 (填字母).(铁架台及夹持仪器略)
a.坩埚 b.蒸发皿 c.圆底烧瓶 d.小烧杯
ZnSO4•7H2O晶体溶解于饱和Na2CO3溶液中,得到6.46g的碱式碳酸锌[Znx(CO3)y(OH)z],为了测定其组成,充分加热分解,产生的气体依次通入浓硫酸和碱石灰,质量分别增重了0.72g和0.88g,则该碱式碳酸锌的化学式

【考点】
电极反应和电池反应方程式;