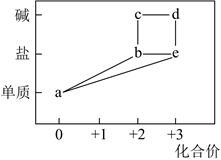
1.
实验室由铁屑制取莫尔盐的主要步骤是:由铁屑与稀硫酸水浴加热制取FeSO4;FeSO4与(NH4)2SO4以等物质的量混合后加热,浓缩结晶得莫尔盐。
(1)
加热铁屑与稀硫酸时常常需要补充蒸馏水,原因。
(2)
实验中为减少硫酸亚铁的损失,过滤分离硫酸亚铁溶液时应注意的问题是。
(3)
为防止Fe2+被氧化,实验中可采取的措施是。
【考点】
铁盐和亚铁盐的相互转变;