1.
某工厂的工业废水中含有大量的FeSO4以及一定量的CuSO4和Na2SO4 , 为减少污染并变废为宝,某学习小组设计以下流程,拟从该废水中回收硫酸亚铁、金属铜,并利用氨碱法原理“制碱”.(除标注外,所加药品或试剂均过量,部分产物及反应条件略去)
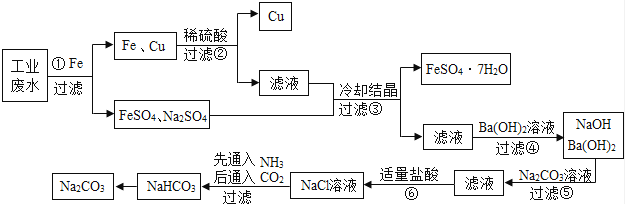
回答下列问题:
(1)
由步骤①可知Fe、Cu的活泼性由强到弱的顺序是 .
(2)
若向步骤②所得的滤液中滴加1~2滴紫色石蕊试液,溶液是 .
(3)
步骤⑤中加Na2CO3溶液的作用是 .由NaHCO3转化成纯碱的化学反应方程式为 .
(4)
“NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl”是氨碱法制纯碱中的重要反应.下列叙述正确的是( ).
A. 析出晶体后剩余溶液中只有一种溶质 B. 该条件下NaHCO3的溶解度比NH4Cl的大 C. 析出晶体后的溶液为NaHCO3的不饱和溶液 D. 在加压条件下向独辟蹊径氨盐水中通入CO2 , 能加速NaHCO3的生成
(5)
该流程①~⑥中,发生了复分解反应的有 .(填写步骤编号)
A. 析出晶体后剩余溶液中只有一种溶质 B. 该条件下NaHCO3的溶解度比NH4Cl的大 C. 析出晶体后的溶液为NaHCO3的不饱和溶液 D. 在加压条件下向独辟蹊径氨盐水中通入CO2 , 能加速NaHCO3的生成
【考点】
金属的化学性质;
盐的化学性质;
复分解反应及其应用;
纯碱的制取;
文字表达式;
