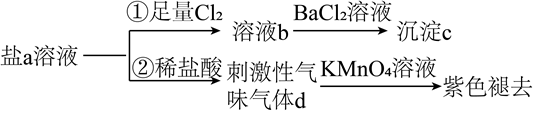
1.
氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成的硫酰氯的反应和实验装置如下所示:SO2(g)+Cl2(g)  SO2Cl2(1) ΔH=-97.3KJ/mol。
SO2Cl2(1) ΔH=-97.3KJ/mol。

已知: 一般条件下,硫酰氯为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中会“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置会分解。
请回答下列问题:
(1)
仪器己中盛放的试剂主要用于排气,该试剂最合适的是(填名称)。
(2)
①装置庚中的药品最合适的是(填字母);
(3)
活性炭的作用是;装置乙和丁中盛有相同的化学试剂,该试剂是,若缺少装置乙和丁,装置丙中会发生副反应,副反应的化学方程式是。
(4)
为提高本实验的硫酰氯的产率,在实验操作中还需要注意的有。
(5)
写出硫酰氯在潮湿空气中“发烟”时生产的新物质的化学式:
a.五氧化二磷 b.碱石灰 c.无水氯化钙 d.硅胶
②装置丙的冷凝管中出水口是(填标号)
a.控制气流速度,宜慢不宜快
b.保证装置的气密性良好
c.先向装置丙中通入一种气体,排出空气后再通入另一种气体
d.先通气体,再通冷凝水
【考点】
含硫物质的性质及综合应用;
能力提升
真题演练