1.
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2,则:
(1)
写出基态E原子的价电子排布式。
(2)
1molA的单质分子中π键的个数为。
(3)
A、B、C三种元素第一电离能由大到小的顺序为 (用元素符号表示)。
(4)
A的最简单氢化物分子的空间构型为。
(5)
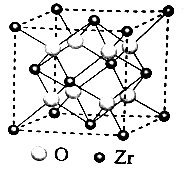
C和D形成的化合物的晶胞结构如图,已知晶体的密度为ρg/cm3 , 阿伏加德罗常数为NA , 求晶胞边长a=cm。(用含ρ、NA的计算式表示)

【考点】
原子核外电子排布;
共价键的形成及共价键的主要类型;
晶胞的计算;
原子轨道杂化方式及杂化类型判断;
能力提升
真题演练

 )的大
)的大


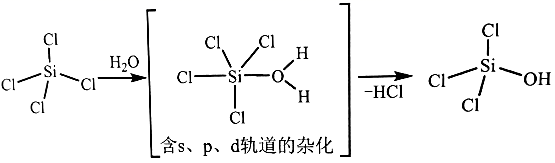 含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2 , 中间体SiCl4(H2O)中Si采取的杂化类型为(填标号)。
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2 , 中间体SiCl4(H2O)中Si采取的杂化类型为(填标号)。