1.
 法可用于吸收燃煤发电厂的
法可用于吸收燃煤发电厂的 , 同时获得产品
, 同时获得产品 。反应的原理为:
。反应的原理为: 。实验室根据上述反应原理,模拟生产硫酸铵。完成下列填空:
。实验室根据上述反应原理,模拟生产硫酸铵。完成下列填空:
(1)
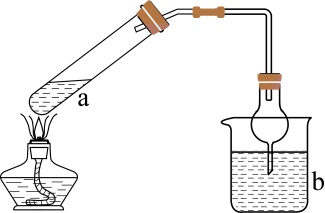
搭建如图装置,先通入 。通入
。通入 的仪器采用干燥管替代长导管的目的是;然后通入
的仪器采用干燥管替代长导管的目的是;然后通入 , 当液体由红色变为浅红色时,立即停止实验,此时溶液的pH范围为,不继续通入
, 当液体由红色变为浅红色时,立即停止实验,此时溶液的pH范围为,不继续通入 直至过量的可能原因是。
(2)
已知
直至过量的可能原因是。
(2)
已知 的溶解度曲线如图。将反应后的混合液进行如下实验:过滤、蒸发浓缩、冷却结晶、过滤、洗涤烘干。两次过滤依次得到的物质分别为和;实验时,烘干温度不易过高,其原因为。
(3)
实验所得
的溶解度曲线如图。将反应后的混合液进行如下实验:过滤、蒸发浓缩、冷却结晶、过滤、洗涤烘干。两次过滤依次得到的物质分别为和;实验时,烘干温度不易过高,其原因为。
(3)
实验所得 的量较少,为提高其产量,工业上可采取的措施是。(任写一条即可)
(4)
若滴定时消耗了
的量较少,为提高其产量,工业上可采取的措施是。(任写一条即可)
(4)
若滴定时消耗了 的NaOH溶液20.00mL,则该硫酸铵产品的纯度为%。
(5)
若蒸馏出的氨气中含有较多水蒸气,则实验结果将(选填“偏大”“偏小”或“无影响”)。
的NaOH溶液20.00mL,则该硫酸铵产品的纯度为%。
(5)
若蒸馏出的氨气中含有较多水蒸气,则实验结果将(选填“偏大”“偏小”或“无影响”)。


为了测定样品中的纯度,进行实验。取1.500g硫酸铵在碱性溶液中反应,蒸馏出生成的氨气,用
硫酸标准液吸收,再用氢氧化钠标准溶液滴定吸收氨气后过量的硫酸。
【考点】
化学实验方案的评价;
能力提升
真题演练