1.
二甲醚是重要的有机合成原料:工业上常用合成气(主要成分为 、
、 )制备二甲醚,其主要反应如下:
)制备二甲醚,其主要反应如下:
反应ⅰ: ,
反应ⅱ: ,
反应ⅲ: ,
(1)
已知 时,由稳定态单质生成
时,由稳定态单质生成 化合物的焓变称为该物质的标准摩尔生成焓
化合物的焓变称为该物质的标准摩尔生成焓 。几种物质的标准摩尔生成焓如下表所示,据此计算
。几种物质的标准摩尔生成焓如下表所示,据此计算
 。
。
(2)
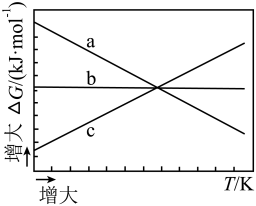
已知 ,
,  随温度变化的三种趋势如下图中线条所示。能用来表示反应ⅰ的线条是(填线条字母)。
(3)
在
随温度变化的三种趋势如下图中线条所示。能用来表示反应ⅰ的线条是(填线条字母)。
(3)
在 催化剂的作用下发生反应ⅰ,其可能反应机理如下图所示。
(4)
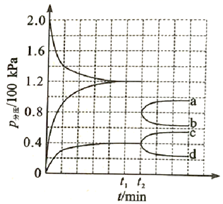
一定温度下,在体积为
催化剂的作用下发生反应ⅰ,其可能反应机理如下图所示。
(4)
一定温度下,在体积为 的刚性容器中充入
的刚性容器中充入 和
和 制备二甲醚,
制备二甲醚, 时达到平衡,平衡时
时达到平衡,平衡时 的转化率为80%,
的转化率为80%, , 且
, 且 。
(5)
实际工业生产中,需要在260℃、压强恒为
。
(5)
实际工业生产中,需要在260℃、压强恒为 的反应釜中进行上述反应。初始时向反应釜中加入
的反应釜中进行上述反应。初始时向反应釜中加入 和
和 , 为确保反应的连续性,需向反应釜中以
, 为确保反应的连续性,需向反应釜中以 、进气流量
、进气流量 持续通入原料,同时控制出气流量。
持续通入原料,同时控制出气流量。
物质 | |||
0.0 |

①根据元素电负性的变化规律,图中反应步骤Ⅲ可描述为。
②在合成甲醇过程中,需要不断分离出甲醇的原因为(填选项字母)。
a.有利于平衡正向移动b.防止催化剂中毒c.提高正反应速率
①内,
。
②反应ⅲ的平衡常数(保留三位有效数字)。
①需控制出气流量小于进气流量的原因为。
②已知出气流量为 , 单位时间内
的转化率为60%,则流出气体中
的百分含量为。
【考点】
化学反应速率与化学平衡的综合应用;
有关反应热的计算;
能力提升
真题演练