1.
汽车尾气(主要成分为NOx和CO)已成为主要的空气污染物来源之一,有发生光化学烟雾污染的潜在危险。
(1)
某小组同学为研究光化学烟雾的形成进行了模拟实验。测得烟雾的主要成分为CxHy(烃)、NO、NO2、O3、PAN(CH3COOONO2),各种物质的相对浓度随时间的变化如右图。根据图中数据,下列推论最不合理的是。(填选项序号字母)
(2)
一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)  2NO2(g),下列可判断反应达平衡的是。(填选项序号字母)
(3)
高温下N2和O2发生N2(g)+O2(g)
2NO2(g),下列可判断反应达平衡的是。(填选项序号字母)
(3)
高温下N2和O2发生N2(g)+O2(g)  2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
(4)
为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
(4)
为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
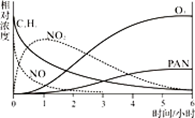
a.NO的消失的速率比CxHy快 b.NO生成NO2
c.CxHy及NO2可以生成PAN及O3 d.O3生成PAN
a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2molNO同时生成2molNO2
①如图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,据此判断反应N2(g)+O2(g) 2NO(g)为(填“吸热”或“放热”)反应。

②2000℃时,向容积为2L的密闭容器中充入10molN2与5molO2 , 达到平衡后NO的物质的量为2mol,则此刻反应的平衡常数K=。该温度下,若开始时向上述容器中充入N2与O2均为1mol,则达到平衡后N2的转化率为。
③汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如图所示。写出其变化的总化学反应方程式:。

例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若16gCH4还原NO2至N2 , 共放出热量867kJ,则ΔH2=。若用标准状况下4.48LCH4还原NO2至N2 , 共转移的电子总数为(阿伏加德罗常数的值用NA表示)。
【考点】
盖斯定律及其应用;
化学平衡常数;
化学平衡的影响因素;
化学平衡状态的判断;
氧化还原反应的电子转移数目计算;
能力提升





