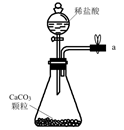
1.1,2-二溴乙烷常用作杀虫剂,某同学用如图装置制备1,2-二溴乙烷。已知:1,2-二溴乙烷的沸点为131℃,熔点为9.3℃。

实验步骤:
I.按图示连接装置,先将C与D连接处断开,再对装置A中粗砂加热,待温度升到150℃左右时,连接C与D,并迅速将A内反应温度升温至160~180℃,从滴液漏斗中慢慢滴加乙醇和浓硫酸混合液,装置D试管中装有6.0mL10mol/LBr2的CCl4溶液,待Br2的CCl4溶液褪色后,进行1,2-二溴乙烷的纯化。
完成下列填空:
(1)
反应前装置A中加入少量粗砂目的是。
(2)
图中A中主要发生的反应的化学方程式:。
(3)
装置B的作用是。
(4)
装置D的烧杯中需加入冷却剂,下列冷却剂合适的为。
(5)
II.1,2-二溴乙烷的纯化
(6)
步骤③中加入无水氯化钙的作用为。
(7)
该实验所得产品的产率为。
a.冰水混合物 b.5℃的水 c.10℃的水
步骤①:冷却后,把装置D试管中的产物转移至分液漏斗中,用1%的氢氧化钠水溶液洗涤。
步骤②:用水洗至中性。
步骤③:“向所得的有机层中加入适量无水氯化钙,过滤,转移至蒸馏烧瓶中蒸馏,收集130~132℃的馏分,得到产品7.896g。
步骤①中加入1%的氢氧化钠水溶液时,发生反应的离子方程式为。
【考点】
有机物的结构和性质;
蒸馏与分馏;
物质的分离与提纯;
制备实验方案的设计;
能力提升
真题演练



 B.
B. 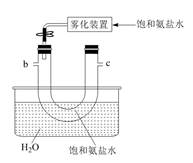 C.
C.  D.
D. 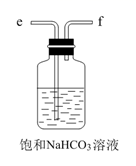 E.
E.