1.环氧乙烷(  ,简称EO)是一种重要的工业原料和消毒剂。由乙烯经电解制备EO的原理示意图如下。
,简称EO)是一种重要的工业原料和消毒剂。由乙烯经电解制备EO的原理示意图如下。
 ,简称EO)是一种重要的工业原料和消毒剂。由乙烯经电解制备EO的原理示意图如下。
,简称EO)是一种重要的工业原料和消毒剂。由乙烯经电解制备EO的原理示意图如下。 
(1)
①阳极室产生Cl2后发生的反应有:、CH2=CH2+HClO→HOCH2CH2Cl。
(2)
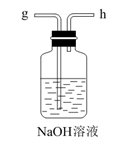
一定条件下,反应物按一定流速通过该装置。
②结合电极反应式说明生成溶液a的原理。
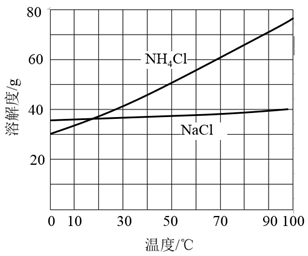
电解效率η和选择性S的定义:
η(B)= ×100%
S(B)= ×100%
①若η(EO)=100%,则溶液b的溶质为。
②当乙烯完全消耗时,测得η(EO)≈70%,S(EO)≈97%,推测η(EO)≈70%的原因:
I.阳极有H2O放电
II.阳极有乙烯放电
III.阳极室流出液中含有Cl2和HClO
……
i.检验电解产物,推测I不成立。需要检验的物质是。
ii.假设没有生成EO的乙烯全部在阳极放电生成CO2 , η(CO2)≈%。经检验阳极放电产物没有CO2。
iii.实验证实推测III成立,所用试剂及现象是。
可选试剂:AgNO3溶液、KI溶液、淀粉溶液、品红溶液。
【考点】
电极反应和电池反应方程式;
常见气体的检验;
电解池工作原理及应用;
氧化还原反应的电子转移数目计算;
能力提升
真题演练







 B.
B. 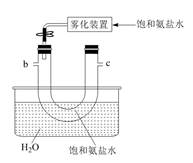 C.
C.  D.
D. 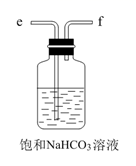 E.
E.