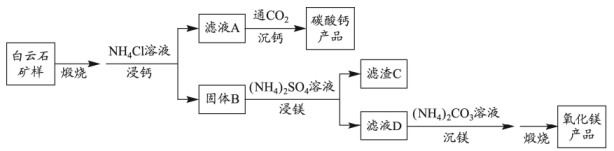
1.我国科学家用粗氢氧化高钴[主要含Co(OH)3]制备硫酸钴晶体(CoSO4•7H2O),其工艺流程如下。


已知:i.还原浸出液中的阳离子有:Co2+、H+、Fe2+和Ca2+等
ii.部分物质的溶度积常数如下(25℃)
物质 | Ksp |
CaF2 | 4.0×10−11 |
Fe(OH)3 | 2.8×10−39 |
iii.CoSO4•7H2O溶解度随温度升高而明显增大
(1)
氢氧化高钴溶于硫酸的化学方程式是。
(2)
还原浸出Co2+时,理论上氧化性离子和还原性离子物质的量之比为。
(3)
氧化沉铁后,浊液中铁离子浓度为 mol/L(此时25℃,溶液pH为4)。
(4)
结合平衡移动原理解释“氟化沉钙”步骤加入过量NaF的原因。
(5)
萃取后,经反萃取得到硫酸钴溶液。将硫酸钴溶液经操作,分离后得到硫酸钴晶体。
(6)
用滴定法测定硫酸钴晶体中钴的含量,其原理和操作如下。
在溶液中,用铁氰化钾将Co(Ⅱ)氧化为Co(Ⅲ),过量的铁氰化钾以Co(Ⅱ)标准液返滴定。反应的方程式为:Co2+ + [Fe(CN)6]3− = Co3+ + [Fe(CN)6]4−。
已知:铁氰化钾标准液浓度为c mol/L,Co(Ⅱ)标准液质量浓度为ρg/L。
取m g硫酸钴晶体,加水配成200 mL溶液,取20 mL待测液进行滴定,消耗V1 mL铁氰化钾标准液、V2 mL Co(Ⅱ)标准液。(Co的相对原子质量为59)
计算样品中钴含量ω=(以钴的质量分数ω计)。
【考点】
难溶电解质的溶解平衡及沉淀转化的本质;
蒸发和结晶、重结晶;
中和滴定;
探究物质的组成或测量物质的含量;
制备实验方案的设计;
能力提升
真题演练