1.研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)
常温下,用0.100 mol/L NaOH溶液滴定10 mL 0.100 mol/L CH3COOH溶液的滴定曲线如右图所示。a、b、c三点中:
(2)
已知:25 ℃时CH3COOH、H2CO3和HClO的电离平衡常数:
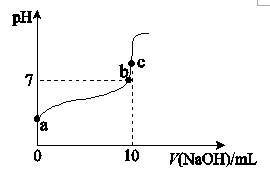
①c(Na+) =c(CH3COO−)的点是.(填“a”、“b”或“c”,下同)。
②水的电离程度最大的点是 。
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 (Ka) | 1.75×10–5 | Ka1=4.5×10–7 Ka2=4.7×10–11 | 4.0×10–8 |
①CH3COOH的电离平衡常数表达式Ka=。
②比较等物质的量浓度溶液的pH:pH(NaClO) pH(CH3COONa) (填“>”、“<”或“=”)。
③预测下列化学反应能够发生的是。
A.HClO + CH3COONa = CH3COOH + NaClO
B.CO2 + H2O + NaClO = NaHCO3 + HClO
C.2CH3COOH + Na2CO3 = 2CH3COONa + H2O+CO2
【考点】
弱电解质在水溶液中的电离平衡;
电离平衡常数;
能力提升
真题演练