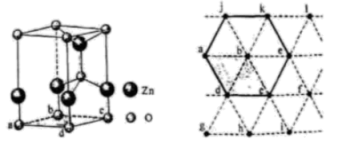
1.绿矾 可作补血剂,其结构如图所示:
可作补血剂,其结构如图所示:
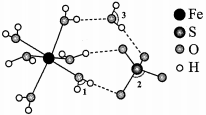
由成键一方单独提供孤电子对给予另外一方,这类“电子对给予—接受”化学键称为配位键.
(1)
按照核外电子排布,可把元素周期表划分成五个区,铁元素位于元素周期表的区.
(2)
基态S原子核外电子空间运动状态有种,电子占据最高能级的电子云轮廓图形状为.
(3)
 中
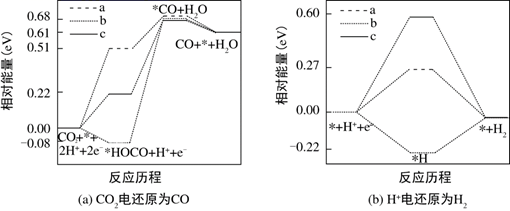
中 由大到小的顺序是.
(4)
二价铁易被氧化为三价铁,结合价层电子排布式解释原因:.
由大到小的顺序是.
(4)
二价铁易被氧化为三价铁,结合价层电子排布式解释原因:.
【考点】
原子核外电子排布;
物质的结构与性质之间的关系;
键能、键长、键角及其应用;
元素周期表的结构及其应用;
能力提升
真题演练





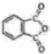 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(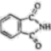 )都是合成菁的原料,后者熔点高于前者,主要原因是。
)都是合成菁的原料,后者熔点高于前者,主要原因是。