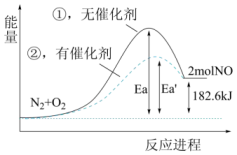
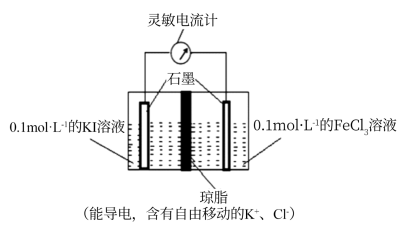
1.已知H2C2O4是一种二元弱酸。室温下,通过下列实验探究NaHC2O4溶液的性质。
实验 | 实验操作和现象 |
1 | 测得10mL0.1mol·L-1NaHC2O4溶液的pH约为5.5 |
2 | 向酸性KMnO4溶液中滴加过量0.1mol·L-1NaHC2O4溶液,溶液紫红色褪色 |
3 | 向0.1mol·L-1NaHC2O4溶液中加入等体积0.1mol·L-1Ba(OH)2溶液,溶液变浑浊 |
4 | 向10mL0.1mol·L-1NaHC2O4溶液中滴加少量0.1mol·L-1NaOH溶液,无明显现象 |
下列说法正确的是( )
A.
依据实验1推测:Kw<Ka1(H2C2O4)×Ka2(H2C2O4)
B.
实验2说明:NaHC2O4溶液具有漂白性
C.
依据实验3推测:Ksp(BaC2O4)>2.5×10-3
D.
实验4反应后的溶液中存在:c(Na+)=c(H2C2O4)+c(HC2O )+(C2O
)+(C2O )
)
【考点】
离子浓度大小的比较;
电离平衡常数;
基础巩固
能力提升
变式训练
拓展培优
真题演练
 乙:
乙:

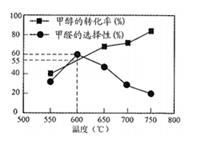


 )的氢烷基化反应的反应机理,下列说法错误的是
)的氢烷基化反应的反应机理,下列说法错误的是