12.某同学在培养皿上做如下实验(如图所示),a、b、c、d是浸有相关溶液的滤纸。向KMnO
4晶体上滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4 + 16HCl = 2KCl + 5Cl2↑ + 2MnCl2 + 8H2O
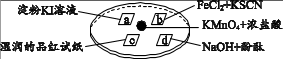
下列对“实验现象”的“解释或结论”描述,不正确的是( )
选项 | 实验现象 | 解释或结论 |
A | a处试纸变蓝 | 氧化性:Cl2 > I2 |
B | b处试纸变红 | Cl2 + 2Fe2+ = 2Cl- + 2Fe3+ |
C | c处试纸褪色 | Cl2与H2O反应生成了具有漂白性的物质 |
D | d处红色褪去 | Cl2 和NaOH反应使溶液呈中性 |